Autor/a: Simon Hackett, Alexis Ogdie ay Laura C. Coates Ther Adv Musculoskel Dis 2022, Vol. 14: 113
| Introducción |
La artritis psoriásica (AP) es una condición heterogénea con afectación musculoesquelética que se manifiesta con síntomas diversos como artritis, dactilitis, entesitis y afectación axial. Además de los síntomas musculoesqueléticos, hasta el 30% de los pacientes tienen psoriasis o enfermedad ungular coexistentes.
La artritis psoriásica (AP) fue definida por primera vez por Moll y Wright en la década de 1970 como “artritis inflamatoria en presencia de psoriasis con ausencia habitual de factor reumatoide”. A pesar de que han pasado casi 50 años desde la primera descripción clínica, el diagnóstico sigue siendo un desafío para los médicos debido a la falta de criterios diagnósticos validados, la naturaleza heterogénea de la afección y la mala identificación de la enfermedad, particularmente en pacientes vulnerables.
En la actualidad, el diagnóstico se basa en la identificación de los signos y síntomas clínicos, evaluados en múltiples dominios, sobre la base de criterios de clasificación. Aunque los criterios de clasificación desarrollados han sido bien validados en la enfermedad establecida, todavía existe la necesidad de la identificación temprana mediante el uso de biomarcadores diagnósticos.
En los últimos años, los tratamientos farmacológicos para la AP se han expandido exponencialmente, aunque los efectos terapéuticos a largo plazo se basan, en gran medida, en la experiencia clínica y no en un extenso análisis basado en ensayos directos. Durante las últimas dos décadas, los tratamientos sintomáticos han evolucionado, desde los fármacos antirreumáticos modificadores de la enfermedad (FARME) tradicionales hasta las terapias biológicas dirigidas.
Aunque el desarrollo de terapias biológicas revolucionó el tratamiento de la AP y mejoró los resultados, la predicción y la medición de los resultados terapéuticos en los pacientes sigue siendo un desafío. Por otra parte, existe un consenso creciente de que es posible identificar y tratar la enfermedad antes de que se desarrollen las características clínicas, lo que posibilitaría una intervención temprana con el objetivo de prevenir la enfermedad.
| Diagnóstico y derivación |
La prevalencia informada de artritis psoriásica (AP) a nivel mundial es del 0,3% al 1% aunque los estudios realizados en todo el mundo a menudo tienen diferencias significativas, lo que refleja diferencias metodológicas, incluyendo las variaciones en las clasificaciones utilizadas, uso de algoritmos de codificación y diagnóstico incorrectos, utilizando criterios de baja sensibilidad como los definidos por la normativa del European Spondyloarthropathy Study Group. Estos factores hacen que sea muy difícil comparar las diferencias en la prevalencia entre los estudios. A pesar de los importantes avances en la comprensión de la fisiopatología de la AP en las últimas décadas, el diagnóstico sigue siendo un probloemático.
Se estima que casi el 50% de los casos en clínicas de atención primaria y secundaria no están reconocidos.
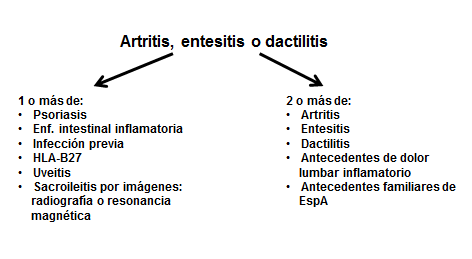
No hay criterios diagnósticos disponibles para la AP. En 2006 se desarrollaron los criterios de la ClASsification of Psoriatic ARthritis (CISPAR) para ayudar a estandarizar la inclusión de una población homogénea de pacientes en los ensayos, y ha quedado bien demostrado que posee sensibilidad y especificidad elevadas. Sin embargo, los criterios de clasificación favorecen la especificidad sobre la sensibilidad y no brindan el diagnóstico. Los pacientes a menudo viven una “odisea de diagnóstico”, con retrasos en la identificación de enfermedades y la consecuente y pronta derivación a atención secundaria.
Los marcadores inflamatorios como la proteína C reactiva y la velocidad de eritrosedimentación son normales en casi el 50% de los pacientes.
Actualmente, no se han identificado biomarcadores séricos que puedan correlacionarse con el diagnóstico. Un estudio reciente analizó retrospectivamente los marcadores serológicos y las comorbilidades en 629 pacientes con psoriasis, incluyendo 102 con AP.
Se analizaron diversos marcadores serológicos, incluyendo los autoanticuerpos antiantígenos nucleares extraíbles, antifosfolípidos y anticitoplasma de neutrófilos, así como parámetros hematológicos e inflamatorios. Ningún marcador serológico fue capaz de distinguir a los pacientes con AP, aunque curiosamente, ciertas comorbilidades fueron más prevalentes en la población con AP. Otros estudios han examinado el papel potencial de las quimiocinas como biomarcadores de diagnóstico.
En 2016, Abji et al. informaron que los niveles de CXCL10 están elevados en pacientes que desarrollan AP en comparación con aquellos con psoriasis sin AP al inicio del estudio. En 2020, el mismo grupo demostró que los niveles de CXCL10 caen después de la aparición de la artritis. Los autores sugirieron que sus hallazgos justifican investigar más el valor predictivo de CXCL10 en el diagnóstico de AP. En definitiva, dicen, el diagnóstico oportuno y la intervención temprana son críticos en la AP, ya que hay estudios que muestran que un tratamiento agresivo de la AP mejora en gran medida los resultados de la actividad de la enfermedad, reduciendo la discapacidad y el daño a largo plazo.
> Identificación temprana de los pacientes
La mayoría de los pacientes con artritis psoriásica (AP) presentan características heterogéneas de la enfermedad, que pueden incluir la afectación de la piel y las uñas, dactilitis, entesitis, espondilitis y artritis. La identificación y diagnóstico posterior de la AP se basan en hallazgos clínicos y no en hallazgos bioquímicos o radiológicos estrictos, lo que a menudo dificulta la identificación.
El primer paso para el diagnóstico de la AP suele ser la autoidentificación de los síntomas.
La mayoría de los pacientes con AP también tienen psoriasis preexistente. Sin embargo, los estudios han demostrado que hay muchos casos establecidos de AP que permanecen sin identificar durante algún tiempo, a pesar del diagnóstico confirmado de psoriasis. Se ha sugerido que la falta de un diagnóstico establecido puede deberse a la escasa comprensión del vínculo entre la piel y la artritis, falta de educación reumatológica de las personas con psoriasis y de los médicos de atención primaria y dermatólogos tratantes.
Para ayudar a impulsar el diagnóstico temprano de este grupo de pacientes "en riesgo", la reciente orientación del National Institute Health and Care Excellence (NICE) para el manejo de la psoriasis recomienda el cribado anual de la AP en los pacientes con psoriasis, tanto en atención primaria como en secundaria. Junto a la orientación para los profesionales de la salud, los intentos de mejorar la selección, como así la distribución de material educativo a los pacientes con psoriasis, puede ayudar a mejorar la asistencia a las pruebas de detección, ya que el momento de la evolución de la enfermedad en el que debe hacerse el cribado también es importante.
Un estudio reciente mostró que los médicos asociados y los enfermeros practicantes en clínicas dermatológicas y de atención primaria, a menudo son los primeros en ver a los pacientes con psoriasis y, por lo tanto, están en una posición ideal para protegerlos de la AP y derivarlos a un reumatólogo.
Aunque el cribado es una herramienta potencialmente útil para identificar a los pacientes con AP, es probable que esté restringida únicamente a los pacientes con psoriasis. La sintomatología compleja de la AP hace que su identificación en atención primaria a menudo sea baja. Una encuesta (Multinational Assessment of Psoriasis and Psoriatic Arthritis ) realizada a 391 dermatólogos y 390 reumatólogos de EE. UU y Europa mostró que >75% declaró que la AP sea probablemente infradiagnosticada debido a una falta de reconocimiento de la conexión que existe entre la piel y los síntomas articulares.
Para abordar el déficit educativo potencial entre los médicos de atención primaria y otros profesionales de la salud, se ha sugerido que las autoridades sanitarias y sociedades académicas deberían crear Campañas de sensibilización dirigidas a los médicos de atención primaria y dermatólogos sobre los síntomas de la AP, con el fin de mejorar la comprensión de la enfermedad.
> Mejorar las vías de derivación y diagnóstico de la artritis psoriásica
El diagnóstico temprano es clave para mejorar los resultados en los pacientes con AP, ya que permite iniciar rápidamente un tratamiento agresivo y dirigido, con antiinflamatorios y modificadores de la enfermedad como el metotrexato o productos biológicos, que dan como resultado una reducción de la progresión del daño articular.
De hecho, en 2018, el American College of Rheumatology/National Psoriasis Foundation Guideline for the Treatment of PsA establecieron que el comienzo temprano de la terapia es fundamental para mejorar los resultados a largo plazo, lo que sugiere la existencia de una ventana de oportunidad clave para el diagnóstico y la intervención en pacientes con AP. Sin embargo, a pesar de la abrumadora evidencia de la importancia de la derivación temprana, es común la derivación tardía y el posterior retraso en el diagnóstico de las artritis inflamatorias, incluida la AP.
Un estudio reciente examinó el retraso diagnóstico en pacientes con artritis psoriásica (AP) que utilizan datos de National Clinical Audit for Rheumatoid and Early Inflammatory Arthritis realizado por la Sociedad Británica de Reumatología. El análisis demostró que los pacientes con AP tuvieron un retraso significativamente mayor hasta la presentación y el diagnóstico que aquellos con artritis reumatoidea, con una tardanza medio de la derivación de 5,4 semanas posteriores a la consulta con su médico general, en comparación con 4,0 semanas para los pacientes con artritis reumatoidea.
Con el fin de ayudar a reforzar la importancia de la derivación, se han propuesto varias medidas para ayudar a reducir el retraso en el diagnóstico. Se han desarrollado guías de atención estándar, como la European League Against Rheumatism (EULAR), para ayudar a los pacientes a que acepten que su médico de atención primaria los derive pronto a un reumatólogo por sospecha de AP. Además de la atención de orientación estándar, para la pronta derivación al especialista es importante la atención multidisciplinaria.
Recientemente, una de las recomendaciones sugeridas es la utilización de 12 puntos que mejoran la colaboración entre dermatólogos, médicos de atención primaria y reumatólogos, que pueden ser clave para reducir la tardanza en el diagnóstico de la AP (ver cuadro). Los autores sugirieron que esto puede tomar la forma de vías de derivación estándar, reuniones del equipo multidisciplinario, clínicas combinadas de acceso rápido, en las que el paciente sea visto por varios especialistas al mismo tiempo.
Para ayudar a facilitar estas vías de derivación se han validado varias pruebas de detección, como Psoriatic Arthritis UnclutteRed Screening Evaluation (PURE-4), Psoriatic Arthritis Screening and Evaluation (PASE) y Psoriasis Epidemiology Screening Tool (PEST), las que pueden ayudar a los médicos a agilizar las derivaciones de pacientes en riesgo. Aunque el retraso en el diagnóstico sigue siendo un problema para los pacientes con AP.
Un estudio dinamarqués publicado en 2015 demostró que entre 2000 y 2011 hubo una reducción importante del retraso diagnóstico en pacientes con artritis inflamatoria, incluida la AP. Aunque esto sugiere que puede haber mayor conciencia de la importancia del diagnóstico temprano de la AP, los hallazgos fueron solo en un país, y en los sistemas de salud de países con niveles de integración entre especialidades más bajos, estas observaciones pueden no traducirse a otras poblaciones. Por lo tanto, es importante que las clínicas combinadas de dermatólogos y reumatólogos se centren en la detección de pacientes con psoriasis, lo que a su vez puede impulsar un diagnóstico más temprano.
| Puntos de acción |
1. Fomentar la evaluación y educación periódicas de paciente en riesgo, como aquellos con psoriasis. 2. Garantizar que las oportunidades educativas apunten a la derivación localizada y las vías diagnósticas. 3. Promover la concientización y colaboración entre los profesionales de la salud, incluidos los médicos de atención primaria, dermatólogos y otros profesionales de la salud afines. |
> Tratamiento y manejo de la artritis psoriásica
Durante los últimos 20 años, las opciones terapéuticas para condiciones reumatológicas como la artritis psoriásica (AP) han evolucionado a un ritmo considerable. En la última década, el tratamiento se ha alejado de los FARME tradicionales, como el metotrexato, hacia el desarrollo de terapias biológicas, como los inhibidores del factor de necrosis tumoral (TNF), los Inhibidores de interleucinas (IL)-12; IL-23 e IL-17), que en una serie de ensayos clínicos han demostrado ser muy eficaces.
La elección del tratamiento varía según la guía: EULAR recomienda el uso del inhibidor del TNF ustekinumab, y de los inhibidores de IL-17 para la artritis periférica que no responde a los FARME. Las recomendaciones terapéuticas de EULAR ayudan en la toma de decisiones y el abordaje del espectro de los fenotipos de la enfermedad observados en los pacientes con AP. Sin embargo, los autores señalan que las pautas deberán ser actualizadas regularmente, a la luz de los datos de los tratamientos emergentes. A diferencia de EULAR, las guías ACR recomiendan, como tratamiento de primera línea, a los inhibidores del TNF más que los FARME orales, como “tratamiento dirigido”.
Las guías de ACR sugieren que este enfoque para el tratamiento temprano con inhibidores del TNF podría retrasar o evitar el daño irreversible de la articulación que ocurre en pacientes con AP, ayudando a mejorar la calidad de vida. Además de las guías terapéuticas EULAR y ACR, en 2015, el Group for the Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA) desarrolló recomendaciones de tratamiento, que fueron actualizadas en 2021, en base a la aparición de nuevos datos de tratamiento y terapéutica.
Los autores sugirieron considerar cuáles dominios están involucrados, así como la preferencia del paciente y cualquier terapia previa o concomitante.
Por otra parte, la elección de la terapia debe abordar el tratamiento en tantos dominios como sea posible (artritis periférica, enfermedad axial, entesitis, dactilitis, piel y uñas). Junto a estos factores se deben considerar las comorbilidades y cualquier otra condición asociada porque pueden afectar la elección de la terapia. Después del inicio del tratamiento, los pacientes deben ser reevaluados periódicamente y la terapia modificada según necesidad.
Sin embargo, a pesar de la variedad de opciones terapéuticas y la eficacia duradera de las terapias, junto con lineamientos cuidadosamente considerados, la predicción de la respuesta al tratamiento dirigido sigue siendo un problema sin resolver. Por otra parte, no está claro por qué ciertos tratamientos no logran controlar la enfermedad adecuadamente en ciertos pacientes. Además de predecir las respuestas al tratamiento, la determinación e implementación del manejo no farmacológico de los pacientes con AP sigue siendo una prioridad para el futuro.
> Predicción de la respuesta al tratamiento: ¿un papel para la medicina de precisión?
La medicina de precisión se define como “un enfoque de medicina emergente del tratamiento y la prevención de las enfermedades que consideran la variabilidad individual genética, ambiental y del estilo de vida. Aunque la medicina de precisión ha sido aplicada en otras áreas de la enfermedad, por ejemplo, la determinación del estado de Her2 en pacientes con cáncer de mama, el uso de la medicina de precisión en reumatología sigue estando en pañales. La AP presenta una oportunidad única para aplicar un enfoque terapéutico racionalizado basado en objetivos, mediante la aplicación de la medicina personalizada.
Numerosos estudios han intentado dilucidar los componentes inmunológicos que sustentan la AP, que han ayudado a impulsar el desarrollo de terapias como el ustekinumab. Aunque los pacientes demuestran una desregulación inmunológica común , como la activación manifiesta de Th17, el inmunofenotipo individual es único e impulsado por una variedad de factores genéticos, ambientales y diferencias tisulares específicas. Por lo tanto, es probable que el inmunofenotipo individual influya en la respuesta a los tratamientos.
Se ha demostrado que esto influyó en un estudio que examinó el uso de la identificación del inmunofenotipo para orientar la elección de la terapia biológica en pacientes con AP. En un estudio de 64 pacientes con AP, la mitad de los pacientes mostró el fenotipo de los linfocitos, lo que orientó el tratamiento hacia el ustekinumab para pacientes con estado de dominancia Th1a activado, secukinumab para pacientes con estado de dominancia Th17 activado y adalimumab o infliximab para pacientes con estado Th1/Th17-hiperactivado.
La otra mitad de los pacientes fue manejada de acuerdo con los agentes biológicos, preferidos, tanto por el médico como por el paciente. En todos los pacientes, la actividad de la enfermedad se evaluó utilizando el índice de actividad de la enfermedad simplificado (SDAI, por sus siglas en inglés), así como las áreas de psoriasis y el índice de gravedad.
Después de 6 meses, la baja tasa de actividad de la enfermedad según el SDAI, a los 6 meses, fue significativamente mayor en el grupo de tratamiento biológico estratégico comparado con el tratamiento biológico preferido por médicos y/o pacientes. Estos hallazgos optimistas sugieren que la mayor aclaración de las vías involucradas en la desregulación inmune en pacientes con AP puede permitir la tipificación fenotípica para guiar el tratamiento adecuado, en muestras de sangre periférica. Aunque esto ofrece un enfoque potencialmente atractivo para personalizar el tratamiento de pacientes con AP, queda por determinar si la tipificación fenotípica puede reflejar con precisión la gravedad de la enfermedad de diversos tejidos.
Para caracterizar aún más las posibles correlaciones, otras áreas de enfermedades como la artritis reumatoidea han explorado el uso de enfoques colaborativos como la formación del consorcio Maximizing Therapeutic Utility in RA (MATURA). Un enfoque similar para la AP puede ayudar a determinar el análisis del mundo real de sangre periférica recolectada de grandes cohortes de pacientes, que luego son seguidos para evaluar la respuesta, para identificar inmunofenotipos predictivos de respuesta, junto con otros factores que se correlacionan con los resultados del tratamiento. Actualmente, junto con las medidas predictivas para pronosticar la respuesta al tratamiento se está desarrollando una variedad de nuevas terapias.
> Manejo holístico del paciente con artritis psoriásica: más allá de la farmacología
Además de los tratamientos farmacológicos existe cada vez más evidencia que sugiere que es muy importante el manejo holístico de la enfermedad en pacientes de reumatología, particularmente respecto del manejo de la calidad de vida y la carga psicosocial asociada a la AP. El papel de otros profesionales de la salud en el manejo de los pacientes con AP abarca una variedad de dominios incluida la atención multidisciplinaria, tratamiento psicológico y manejo del dolor.
Las pautas actuales emitidas por el enfoque EULAR apoyan el manejo de la AP principalmente desde la perspectiva reumatológica. Sin embargo, es bueno reconocer que otros profesionales de la salud, incluidos los médicos de atención primaria y los dermatólogos, representan un papel importante en el tratamiento y el manejo de los pacientes con AP. Junto con el manejo de los síntomas articulares y cutáneos, se ha demostrado que la carga de comorbilidad en los pacientes con AP es significativamente mayor que en la población general, con mayor prevalencia de hiperlipidemia, hipertensión y enfermedad inflamatoria intestinal.
En comparación con la población general, los pacientes con artritis psoriásica (AP) tienen un 55% más de riesgo de desarrollar un evento cardiovascular, con una prevalencia significativamente mayor de infarto de miocardio, enfermedades cerebrovasculares e insuficiencia cardiaca.
Por otra parte, los pacientes con artritis psoriásica (AP) parecen tener mayor riesgo cardiovascular en comparación con los pacientes que solo tiene psoriasis. Se ha desarrollado una hipótesis que dice que el estado inflamatorio crónico característico de la AP contribuye al aumento de la carga de comorbilidad observada en los pacientes.
Por lo tanto, la naturaleza multisistémica de la artritis psoriásica (AP) requiere que los pacientes sean manejados y atendidos por múltiples especialistas. Es probable que el modelo en evolución del enfoque multidisciplinario integre la atención primaria a la lista de profesionales de la salud. Los autores consideran que hay que tener en cuenta que, probablemente, los enfoques serán dictados por los sistemas de atención médica locales y asignaciones de recursos.
La artritis psoriásica (AP) se asocia con una considerable carga psicosocial.
De hecho, estudios previos han demostrado que los pacientes con AP no solo tienen una calidad de vida considerablemente peor en comparación con la población general sino que la calidad de vida y el estado funcional también son considerablemente peores en comparación con los pacientes con psoriasis o artritis reumatoidea. Un estudio reciente sugirió que el tratamiento de la AP y el dolor asociado no puede ser efectivo sin abordar todos los factores psicosociales, incluido el manejo simultáneo de los problemas psicológicos. Es claro, dicen, que los problemas cutáneos y articulares pueden ser abordados por el dermatólogo y el reumatólogo, mientras que los problemas psicológicos tendrán que ser evaluados por un psicólogo.
Por otra parte, un estudio de sección transversal realizado en 131 clínicas ambulatorias de AP mostró fatiga, trastornos del sueño, ansiedad/depresión, deterioro de la función física, desempleo y presencia de comorbilidades, independientemente asociadas con el deterioro de la calidad de vida relacionada con la salud. Además de reconocer esta carga de enfermedad que enfrentan los pacientes, una pregunta importante que los reumatólogos deben tener en cuenta es: ¿qué papel representa, si es que así sucede, el ambiente proinflamatorio en cuanto a su contribución a la mayor carga psicosocial observada en pacientes con AP? Los estudios han demostrado que hay ciertas citocinas inflamatorias, incluidas IL-6 e IL-12, que representan un papel en el desarrollo de la depresión.
El tratamiento temprano agresivo de pacientes con AP dirigido a las citocinas clave involucradas en los componentes neuroinflamatorios de la depresión puede resultar en un posible curso de acción en el manejo de los cambios de humor.
Es de destacar que en otras artritis inflamatorias, como la artritis reumatoidea, los síntomas depresivos permanentes se correlacionan con respuestas reducidas al tratamiento, respecto del control de la enfermedad.
Estos hallazgos también se han observado en un estudio multicéntrico prospectivo noruego, de pacientes con AP, depresión y ansiedad, que redujeron la probabilidad de remisión conjunta después del tratamiento. la extrapolación de los datos de este estudio a pacientes con AP permite argumentar que el abordaje de cualquier cambio de humor temprano después del diagnóstico debe ser una prioridad en la prestación de la atención integral de los pacientes. En última instancia, estos hallazgos resaltan la importancia del manejo psicosocial de los pacientes y, lo que es más importante, dada la naturaleza crónica de la AP, sugiere que los pacientes deben ser evaluados periódicamente, en particular, tras cualquier aumento de actividad de la enfermedad.
A pesar de la prevalencia del dolor en pacientes con AP, los ensayos terapéuticos no siempre han informado específicamente al dolor como resultado, aunque ensayos más recientes, como el estudio FUTURE 2, han demostrado que el tratamiento con secukinumab ofrece una reducción significativa y sostenida del dolor durante un período de 2 años. Incluso con el desarrollo y el uso de FARME y productos biológicos, el tratamiento del dolor persistente es un problema importante para resolver en pacientes con AP.
En un estudio de EULAR, un cuestionario, el Psoriatic Arthritis Impact of Disease (PsAID) identificó al dolor como el dominio de salud más importante que afecta la calidad de vida relacionada con la salud. Alrededor de un tercio de los pacientes con AP que reciben tratamiento biológico reportan dolor leve o nulo, un tercio, dolor moderado y el tercio resultante, dolor severo.
El dolor es claramente común en los pacientes con artritis psoriásica (AP) que reciben tratamiento. Cuanto más intenso es, mayor es el impacto en el funcionamiento físico, la productividad laboral y el compromiso con las actividades. Incluso con la mejoría de los síntomas del dolor en pacientes con AP tratados, el mejoramiento de la calidad de vida requiere que el tratamiento sea rápido, eficaz y prolongado.
Para el dolor refractario o difícil de controlar debe considerarse la derivación inmediata a especialistas en dolor, desde un enfoque de manejo multidisciplinario. Para ayudar a racionalizar los enfoques para el manejo del dolor, también hacen falta más estudios para redactar guías de consenso sobre las estrategias óptimas para el manejo del dolor en pacientes con AP.
| Puntos de acción: |
1. La implementación de un manejo multidisciplinario de los pacientes con AP debe seguir siendo una prioridad en todos los departamentos de reumatología 2.Considerar la incorporación periódica de los resultados psicológicos. y el manejo del dolor en ensayos de diseños clínicos 3. Considerar la posibilidad de derivar rápidamente a especialistas en dolor, cuando el dolor permanece incontrolado 4. Se deben desarrollar guías para el manejo óptimo del dolor en pacientes con AP utilizando evidencia emergente de ensayos recientes |
> Evaluación de la actividad de la enfermedad en la artritis psoriásica
La evaluación de la actividad de la enfermedad es fundamental para orientar el tratamiento. En los últimos años, se ha desarrollado una gama de sistemas de puntaje compuestos, para evaluar de forma precisa y confiable la enfermedad. Sin embargo, a pesar de la creación de herramientas de evaluación, como la Minimal Disease Activity (MDA), el Psoriatic Arthritis Disease Activity Score (PASDAS) y el Disease Activity Index for Psoriatic Arthritis (DAPSA), la heterogeneidad inherente a la AP hace que la traducción de tales síntomas a un método validado que sea relevante para todas las mediciones es muy difícil.
Por lo tanto, un tema de gran interés es el desarrollo de nuevas herramientas para evaluar la actividad de la enfermedad a través de biomarcadores y enfoques de base tecnológica es. Estas evaluaciones también pueden ayudar a dirigir la atención y actuar como herramienta de clasificación; Por ejemplo, si el paciente necesita ser atendido con prontitud o en una visita más adelante.
> Biomarcadores de enfermedad
Dada la heterogeneidad clínica de la artritis psoriásica (AP), durante mucho tiempo se han buscado biomarcadores reumatológicos potenciales que reflejen la respuesta al tratamiento. Con respecto a la respuesta al tratamiento, durante mucho tiempo se han sugerido posibles biomarcadores que incluyan el número de células sinoviales CD3+, proteína C reactiva y metaloproteasa-351 de la matriz, para denominar solo a unos pocos.
En una revisión sistemática reciente del tratamiento, la de respuesta de los biomarcadores sugirió que la PCR y la posterior respuesta a la terapia biológica es potencialmente de gran utilidad clínica, aunque los estudios examinaron solo a pacientes tratados con terapia anti TNF. La capacidad del reumatólogo para diagnosticar con precisión y predecir las respuestas al tratamiento en pacientes con AP sigue siendo una necesidad médica insatisfecha que justifica considerar cuidadosamente en ensayos clínicos futuros.
> Métodos de base tecnológica
A medida que las clínicas de reumatología se vuelven cada vez más “digitalmente maduras”, el desarrollo y la integración de la tecnología para apoyar el autocontrol y la autogestión se ha expandido en gran medida. Estas tecnologías brindan una oportunidad única no solo para ayudar a monitorear y guiar el tratamiento sino también para recopilar evidencia del mundo real, de los resultados a largo plazo en pacientes tratados. El uso de la tecnología digital ya ha sido examinado en pacientes con artritis reumatoidea, en diversas aplicaciones, incluyendo el informe de los síntomas antes de la asistencia clínica, el monitoreo remoto, el seguimiento de los síntomas y los síntomas atormentadores, a través de una mayor percepción de los cambios durante la evolución de la enfermedad.
La pandemia de COVID-19 ha presentado importantes desafíos tanto para los reumatólogos como para los pacientes por igual. Junto con las consecuencias directas de la pandemia, el manejo y seguimiento de los pacientes se ha visto gravemente afectada debido a una variedad de factores que incluyen restricciones sociales y de viajes, y redespliegue de profesionales sanitarios. Teniendo en cuenta los desafíos que enfrentan los médicos ante pacientes con AP, se ha explorado el uso de sensores de teléfonos inteligentes como herramienta para medir cuantitativamente los síntomas de la enfermedad.
Recientemente, se desarrollaron 3 nuevas herramientas de medición basadas en sensores de teléfonos inteligentes, como parte de Psorcast para evaluar los síntomas de la AP que afectan determinados dominios. La herramienta Digital Jar Open (N. de la T: mide el rango funcional de movimiento sin dolor de las articulaciones) utiliza el giroscopio para medir la rotación hacia adentro y hacia afuera de cada brazo para generar un puntaje de simetría hacia adentro y hacia afuera, que se normaliza dentro de cada participante.
La herramienta 30-Second Walk (Caminata de 30 segundos) mide la caminata con el teléfono inteligente en el bolsillo, para generar un puntaje de simetría usando PdKit. La Finger Toe Photo (Foto de los dedos de los pies) captura imágenes de los dedos de las manos y los pies, normalizándolas con el ancho contralateral del lecho ungueal para medir el ancho relativo de los dedos.
La valoración de esta novedosa herramienta en los pacientes reclutados hasta el momento ha demostrado que las 3 mediciones basadas en sensores pueden distinguir algunas características clínicas de la AP. Aunque se necesita una mayor validación, estas y otras herramientas de Psorcast podrán prever una autoevaluación remota cuando no se pueden realizar visitas clínicas. Se destaca que la medición longitudinal y frecuente de los síntomas podría ser de gran valor para estudiar la progresión de la enfermedad y evaluar la respuesta al tratamiento.
Además de las herramientas como el Psorcast, también se ha propuesto el uso de Inteligencia Artificial (IA) como herramienta para ayudar a predecir la progresión de la enfermedad y los brotes, e identificar a los pacientes "en riesgo" con mayor propensión a desarrollar AP en un contexto de psoriasis. De hecho, en 2019, EULAR publicó una serie de puntos que los desarrolladores y profesionales sanitarios deben tener en cuenta a la hora de evaluar la implementación de aplicaciones de salud móvil en reumatología.
Además de la IA, el uso de mHealth, también puede resultar útil, tal como lo define la OMS, “el uso de tecnologías móviles e inalámbricas para ayudar a lograr los objetivos de salud, para fomentar el autocontrol de la enfermedad en pacientes con AP”.
El potencial de la mHealth en el manejo de pacientes ha sido revisado por Fagni et al., y aunque los autores son optimistas acerca del potencial de la adopción de mHealth en los pacientes con AP, persisten varias barreras para una implementación exitosa, incluidos los bajos niveles de alfabetización tecnológica entre los pacientes mayores, la falta de aplicaciones de alta calidad en términos de precisión científica y cumplimiento de guías basadas en evidencia.
| Puntos de acción: |
1. Establecer mejor la importancia clínica de los biomarcadores, en cohortes mejor definidas. 2. Debe continuar la validación de nuevas herramientas tecnológicas, para determinar la actividad de la enfermedad y los resultados en los pacientes. 3. Considerar la implementación de IA para la predicción y previsión de la progresión de la enfermedad y de los síntomas. |
| Avanzando hacia la prevención de enfermedades |
Aunque se ha realizado un esfuerzo importante en el manejo y tratamiento de la AP, cada vez hay más pruebas que sugieren que centrarse en el paciente de mayor riesgo de desarrollar AP puede permitir intervenciones que retarden la aparición de enfermedades o incluso prevenirlas. Por lo tanto, los interrogantes son claros: ¿qué pacientes están en riesgo de desarrollar AP? y ¿cómo puede progresar la enfermedad? ¿Se puede prevenir?
En los últimos años, la teoría de que la psoriasis y, de hecho, la AP, son afecciones superpuestas, ambas promovidas por un a ambiente proinflamatorio ha ganado una fuerza considerable. Ha quedado bien demostrada la existencia de un vínculo estrecho entre la psoriasis como factor de riesgo de la AP. Hasta el 30% de los pacientes con psoriasis tienen manifestaciones sinovioentésicas inflamatorias.
La psoriasis a menudo precede a la afectación inflamatoria de las articulaciones, en un promedio de 7 años, lo que sugiere que hay tiempo suficiente para la intervención.
En esta población de pacientes se han identificado una serie de factores de riesgo que sugieren un mayor riesgo de desarrollar AP, incluyendo una importante gama de mutaciones de histocompatibilidad complejas (MHC), como HLA-Cw*0602, HLA-B27, HLA-B38, HLAB39, así como mutaciones no MHC, aumento del índice de masa corporal y distribución corporal de la psoriasis y su gravedad. Sin embargo. el análisis actual de, los datos disponibles no han logrado encontrar una sola variable que permita predecir adecuadamente la transición a la enfermedad sinovioentésica.
Reflexionar sobre las etapas evidentes de la enfermedad en la AP también puede ofrecer información sobre cómo dirigirse a los pacientes en riesgo de desarrollar AP. Un estudio de consenso Delphi reciente tuvo como objetivo ayudar a definir subgrupos específicos de individuos durante las etapas subclínica y clínica de la AP, para ser usado en estudios de investigación. Tras un proceso Delphi de 3 rondas, se llegó al consenso de 3 términos y definiciones: “mayor riesgo de AP”, “psoriasis con anomalías asintomáticas de la imagen sinovioentésica” y “psoriasis con síntomas musculoesqueléticos no explicados por otro diagnóstico”.
Se espera que la identificación de estos términos permita establecer una población de pacientes bien definida en el estudio de pacientes con riesgo de desarrollar AP. Una revisión sistemática reciente de la literatura y un metaanálisis examinaron una variedad de predictores de AP en pacientes con psoriasis. Los autores identificaron 26 artículos que fueron considerados adecuados para su inclusión y análisis.
Los artículos trataban de pacientes con psoriasis y artralgias e inflamación musculoesquelética en las imágenes, con un alto riesgo de desarrollar AP, con índice de masa corporal aumentado y antecedentes familiares de AP. Estos hallazgos pueden resultar útiles para ayudar a identificar la AP en su fase subclínica, lo que potencialmente permitirá el diseño de ensayos destinados a prevenir el desarrollo de la AP.
También se ha estudiado el rol del tratamiento y el desarrollo de la AP en pacientes con psoriasis. Un estudio retrospectivo no aleatorizado de pacientes con psoriasis en placas, de moderada a grave, que recibieron terapia con agentes antirreumáticos biológicos durante más de 5 años fueron evaluados para detectar el desarrollo de AP, y se analizaron las tasas de incidencia anual y acumulada.
Los autores demostraron que los FARME biológicos pueden retrasar o reducir el riesgo de AP en la psoriasis moderada a grave, lo que sugiere que la modalidad terapéutica puede desempeñar un papel importante en el riesgo a largo plazo. Un estudio de cohorte retrospectivo examinó 193.709 pacientes con psoriasis pero sin AP y mostró que el uso de agentes biológico se asoció con el desarrollo de AP en pacientes con psoriasis, aunque se reconoce que esto puede haber estado relacionado con la confusión por indicación y sesgo protopático.
Por lo tanto, está claro que se requieren más estudios, en particular prospectivos, para dilucidar la relación entre el riesgo y el desarrollo de AP. Junto con los factores de riesgo subyacentes, la transición de la psoriasis a la AP probablemente resulte de la interacción entre los genes, la inmunidad y el medio ambiente.
Se ha propuesto que evoluciona a por etapas. La transición propuesta incluye el establecimiento de un ambiente proinflamatorio junto con la psoriasis, a través de la interacción genética y factores ambientales.
La fase subclínica incluye la activación del eje IL-23/IL-17 junto con la producción de TNF-α. Después de esto se hace evidente una fase subclínica, con la aparición de biomarcadores solubles y sinovioentesitis seguida poco después por una fase prodrómica de artralgias. La fase final produce resultados clínicamente evidentes de AP, con síntomas clásicos como sinovitis, entesitis, dactilitis y enfermedad axial asimétrica. Está claro, por lo tanto, que la identificación temprana de los pacientes antes de que la enfermedad avancen más allá de la fase subclínica de psoriasis-enfermedad AP.
La identificación temprana de estos pacientes sigue siendo desafiante, pero el interés por el papel de biomarcadores que identifiquen a las personas según la estratificación del riesgo de progresión de la enfermedad sigue siendo un área activa de interés en pacientes con AP. Aunque actualmente no se cuenta con biomarcadores validados, las concentraciones séricas iniciales del ligando 10 de quimiocina CXC (CXCL10) elevadas en pacientes con psoriasis se correlacionan con el riesgo de desarrollar AP.
Por otra parte, otros biomarcadores que clínicamente se muestran potencialmente relevantes son M2BP e ITGB5, que son una promesa potencial para ayudar a los médicos a identificar a los pacientes con riesgo de progresión de la enfermedad. Además de la identificación de biomarcadores, el uso de modalidades de imágenes, como la ecografía y la resonancia magnética, puede ayudar a detectar a los pacientes con enfermedad articular silenciosa, aunque aún se desconoce la capacidad predictiva del modo de detección de tales cambios.
Aunque la identificación y el cribado de la AP en pacientes con psoriasis debe continuar siendo un enfoque importante, el mismo debe basarse en los pacientes que presentan enfermedad cutánea antes de que aparezcan los síntomas, lo que no es el caso para todos los pacientes.
El subconjunto de pacientes sin enfermedad de la piel puede requerir estrategias alternativas para asegurar un diagnóstico precoz. Por otra parte, el desarrollo de una herramienta predictiva que utilice datos de pacientes con psoriasis que pueden estar en riesgo de desarrollar AP puede ayudar en el diseño de medidas preventivas.
| Puntos de acción: |
1. Es prioridad el esclarecimiento de biomarcadores que permitan predecir cuáles pacientes están en riesgo de progresión de la enfermedad 2. Establecer el diálogo entre pacientes y profesionales de la salud para determinar la gravedad de la enfermedad, antes de iniciar el tratamiento, para garantizar un equilibrio entre el beneficio terapéutico y cualquier riesgo potencial 3. Continuar definiendo subgrupos específicos de individuos durante las fases subclínica temprana y clínica de la AP, para su análisis en estudios de investigación preventiva 4. Aprovechar los diversos métodos de comunicación para educar sobre su enfermedad a la población de pacientes en riesgo. 5. Desarrollar diseños para estudios intervencionistas para prevenir o retrasar el desarrollo de AP. |
| Conclusión y guías futuras |
Está claro que la comprensión y el tratamiento de la AP ha evolucionado rápidamente en los últimos años. A pesar de los rápidos avances aquí descritos todavía hay una serie de problemas médicos no cubiertos.
Una prioridad clave para médicos y pacientes es poder identificar la enfermedad tempranamente y facilitar el acceso rápido al tratamiento. Aunque en los últimos años se hicieron variados esfuerzos para abordar estos desafíos, el progreso y la implementación ha sido lenta, a menudo acompañado por expectativas poco realistas.
Los autores creen que la comunidad AP se encuentra al borde del precipicio: Ahora es el momento de hacer una pausa, reflexionar, consolidar ideas y buscar las vías más apropiadas para explorar y lograr una atención óptima del paciente, con mejores resultados.